武汉禾元生物科技股份有限公司品牌商
16 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 1.2000000000000002
- 0.20000000000000018
品牌商
武汉禾元生物科技股份有限公司
入驻年限:16 年
- 联系人:
卫经理
- 所在地区:
湖北 武汉市
- 业务范围:
技术服务、体外诊断、医疗器械、试剂、细胞库 / 细胞培养、原辅料包材
- 经营模式:
生产厂商 科研机构
推荐产品
公司新闻/正文
无动物源性!新型植物源成分助力CGT研发与生产
1071 人阅读发布时间:2023-11-17 14:00
近几年细胞基因治疗 (Cell and Gene Therapy, CGT)在癌症、代谢类疾病、退行性疾病以及先天遗传性疾病等治疗方面取得了突破性成果,也是现在最火热的治疗技术之一,国家也陆续出台多项政策促进CGT的进步发展。2020年5月,国家发改委印发《“十四五”生物经济发展规划》,在第(五)部分“加快提升生物技术创新能力”的“开展前沿生物技术创新”中提到:发展基因诊疗、干细胞治疗、免疫细胞治疗等新技术,强化产学研用协同联动,加快相关技术产品转化和临床应用,推动形成再生医学和精准医学治疗新模式。
一、细胞基因治疗技术分类
细胞治疗:指利用患者自身或供者来源的细胞,经过体外分离纯化、培养扩增、活化或基因修饰、基因编辑等操作,再回输到患者体内,从而达到治疗疾病的治疗方式。从细胞类型上区分,细胞治疗主要可分为免疫细胞治疗、干细胞治疗和其它体细胞治疗。
基因治疗:基因治疗是一种利用基因载体将外源的正常基因或有治疗作用的基因导入靶细胞,或用具有正常功能的基因置换/增补患者体内有缺陷的基因,从而达到治疗疾病的方法。从载体形式上区分,基因治疗相关技术可分为病毒载体编辑技术和非病毒载体的编辑技术。
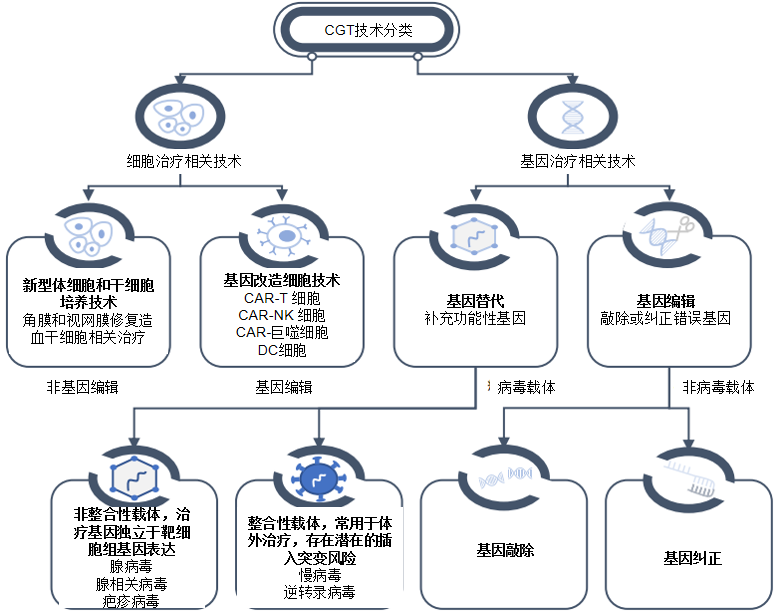
图1:CGT技术分类(来源:沙利文分析)
二、动物来源原辅料在CGT中的安全性问题
2010年葛兰素史克公司(GSK)生产的轮状病毒(Rotavirus,RV)疫苗 Rotarix 中被检测出I型猪圆环病毒(Porcine circovirus,PCV)的DNA片段[1],不久FDA发布消息称在 Rotarix 中检出了外源性病毒成分,因此,建议暂时停止使用该疫苗。该事件引发了人们对动物源性原材料可能会给生物制药带来严重的安全隐患的思考。
CGT生产过程如细胞培养、细胞库开发等阶段中会用到一些动物源的原辅料,比如血清(人源)、人血白蛋白(人源)、胎牛血清(牛源)以及胰酶(猪源)等,因此可能存在将一些动物源性的病毒因子引入到终产品的风险,而这些动物源性病毒因子最终可能会随着CGT药品一同被输送至患者体内,从而引发相关的传染性疾病。这些动物源性的病毒因子除了给患者造成身体损害,也给CGT生产企业造成巨大压力和经济损失,因为CGT产品生产的各个阶段都需要做严格的病毒检测,这些检测既是CGT行业质量控制的重要指标,同时也给生产企业增加了生产成本。
2020版中国药典中强调:“对于不同风险级别原材料的质量控制,应充分考虑来源于动物(或人)的生物原材料可能带来的外源因子污染的安全性风险。而对于高风险等级的原材料,应在产品研发的早期评价使用这些原材料的必要性,并寻找其他替代物或替代来源。”[2]
另有多个CGT相关行业技术指导原则特别指出在CGT生产过程中应尽可能避免使用动物源性原辅料:
表1. CGT相关行业技术指导原则中对动物源原辅料的要求
| 发布时间 | 发布机构 | 技术指导名称 | 具体要求内容 |
| 2015 | CDE | 《干细胞制剂质量控制及临床前研究指导原则》(试行)[3] | 除特殊情况外,应尽可能避免在干细胞培养过程中使用人源或动物源性血清,不得使用同种异体人血清或血浆。如必须使用动物血清,应确保其无特定动物源性病毒污染。严禁使用海绵体状脑病流行区来源的牛血清。应结合体内和体外方法,根据每一细胞制剂的特性进行人源及动物源性特定致病因子的检测。如使用过牛血清,须进行牛源特定病毒的检测;如使用胰酶等猪源材料,应至少检测猪源细小病毒;如胚胎干细胞和iPS细胞在制备过程中使用动物源性滋养细胞,需进行细胞来源相关特定动物源性病毒的全面检测。另外还应检测逆转录病毒。 |
| 2017 | CDE | 《细胞治疗产品研究与评价技术指导原则》(试行)[4] | 细胞培养过程中,应尽量避免使用动物或人来源的物质,比如应尽量避免血清的使用,若必须使用血清,需要提供相关的研究资料说明使用的必要性和合理性;严禁使用疫病流行区来源的动物血清;不得使用未经过安全性验证的血清。 |
| 2023 | CDE | 《腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则》(试行)[5] | 原材料和辅料的质量控制可参照《中国药典》通则“生物制品生产用原材料及辅料质量控制”的相关要求,质控策略应与其风险相符。如有可能,应尽量避免使用动物源或人源性原材料。如需使用,需提供相关的必要性和合理性证明,并制定相应的风险控制措施。 |
CGT制品生产过程复杂而精细,任何关键步骤的细微变化均可能引起终产品性能的改变,而动物源原辅料除了存在外源性病毒风险之外,还存在来源多样、成分复杂、批间差控制难度大等问题,这些对CGT制品的质量、稳定性以及安全性都会造成影响。因此,动物源性也是CGT监管申报存在的主要问题之一。这也导致无血清、无动物源性的原辅料也越来越被行业普遍接受。
三、植物源原辅料在CGT研发与生产中的优势
禾元生物依托自己的专利技术平台—— 水稻胚乳细胞生物反应器高效重组蛋白质表达平台(OryzHiExp)和重组蛋白纯化技术平台(OryzPur)开发了一系列适合CGT研发与生产的原辅料:
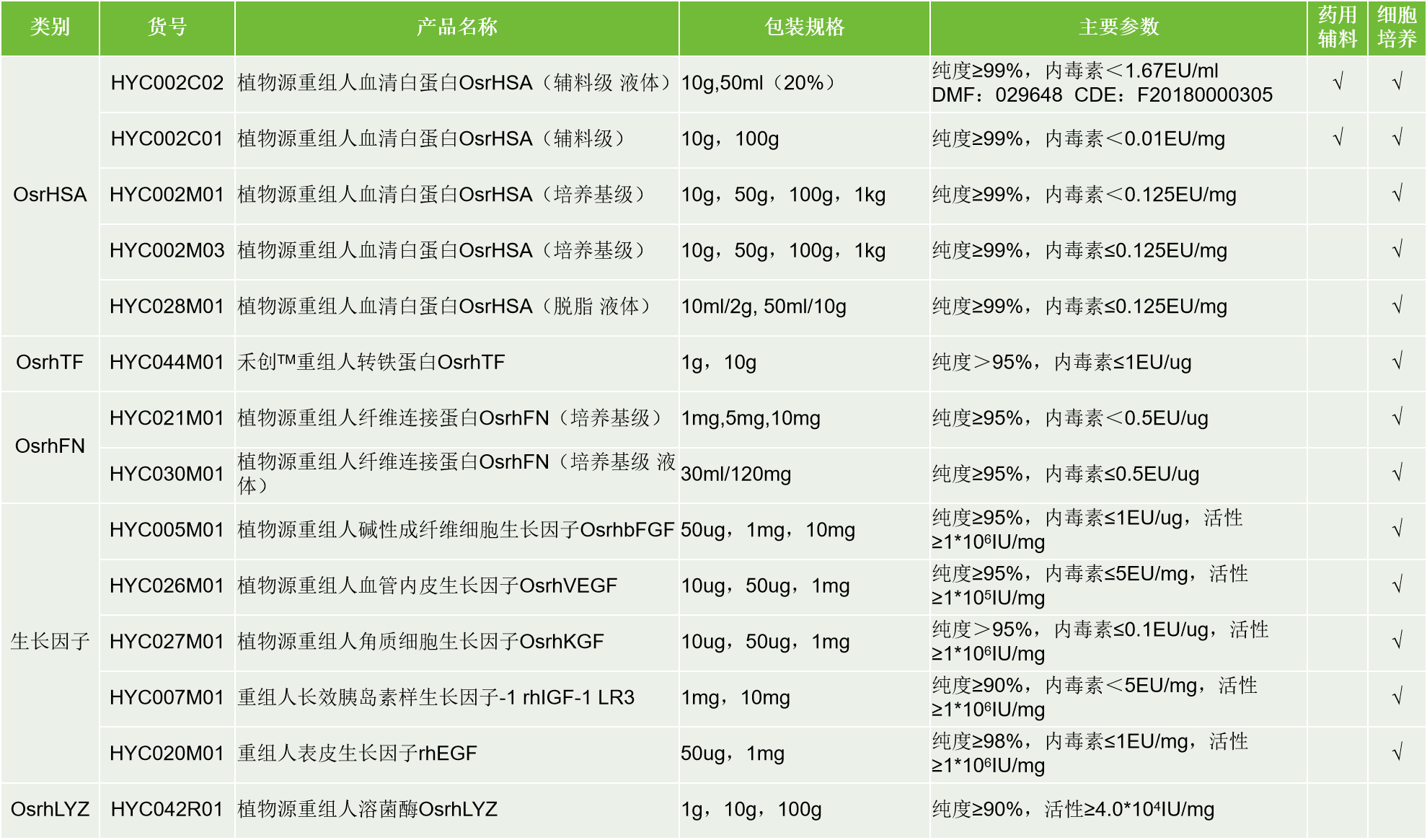
上述产品均不含有任何人或动物来源的成分,在CGT研发或生产中具有以下优势:
- 安全性好,消除动物来源或血液制品中病毒和其他未知因素的潜在风险;
- 高批间一致性,提高了细胞培养和实验结果的重复性;
- 质量可控,排除动物来源的末知成分与含量不明确蛋白造成的批间差;
- 供应稳定,产能充足;
- 成分明确,简化下游生物加工或生物研究;
- 高纯度,低内毒素,低杂质
参考文献:
[1] Victoria JG,Wang CL,Jones MS,et al. Viral nucleic acids in live-attenuated vaccines: detection of minority variants and anadventitious virus[J]. J Virol,2010
[2]《生物制品生产用原材料及辅料质量控制》,2020版中国药典
[3]《干细胞制剂质量控制及临床前研究指导原则》(试行)
[4]《细胞治疗产品研究与评价技术指导原则》(试行)
[5]《腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则》(试行)